Die Welt geht bekanntlich nicht immer gerecht mit denen um, die Bedeutsames leisten. Auch Johann Wilhelm Ritter hätte das so gesehen, denn der in Schlesien geborene Apotheker und Physiker starb 1810 mit gerade mal 33 Jahren verarmt in München. Dabei hat er nur wenige Jahre zuvor die erste wiederaufladbare Batterie gebaut, die sogenannte Ritter’sche Ladungssäule, indem er Kupferscheiben und mit Kochsalzlösung getränkte Pappstücke in einer Glasröhre übereinanderstapelte. Nachdem die Röhre aufgeladen ist, gibt sie den Strom wieder ab, selbst wenn die Ladeapparatur entfernt ist. Nicht anders arbeitet im Grunde ein hochmoderner Lithium-Polymer-Akku in einem aktuellen Elektroauto. Eine wiederaufladbare Batterie speichert elektrische Energie nämlich chemisch und gibt sie auch als elektrische Energie wieder ab. Bei jeder Umwandlung bleibt ein Teil der zugeführten Energie auf der Strecke, so wollen es die Gesetze der Thermodynamik. Die Funktion der Akkus beruht dabei auf der Elektronegativität von Metallen, einfacher gesagt: auf deren Eigenschaft, Elektronen abzugeben.
Lithium kommt ins Spiel
Am besten geeignet sind die Atome des Lithiums, des elektronegativsten aller Metalle und nach Wasserstoff und Helium des atomar leichtesten Elements im Periodensystem. Die Lithium-Atome geben besonders gern eines ihrer je drei Elektronen ab, was Lithium zum beliebten Grundstoff für Akkus macht. Diese Eigenschaft führt jedoch auch dazu, dass die Lithium-Atome gern chemische Bindungen mit anderen Atomen und Molekülen eingehen. Sie müssen also in der Batterie geschützt und von Luft oder Wasser ferngehalten werden, was mit zusätzlichem Gewicht einhergeht. Ein weiterer Nachteil: Lithium ist zwar auf der Erde keineswegs selten, doch in so geringer Konzentration vorhanden, dass wirtschaftliche Förderung nur an wenigen Orten möglich ist. Dennoch konzentriert sich ein großer Teil der Batterieforschung auf Lithium-Ionen-Akkus.
Vereinfacht gesagt geben hier Lithium-Atome beim Entladen ihre überzähligen Elektronen an der Anode ab. Die Elektronen strömen durch Leiter und Verbraucher zur positiven Elektrode, der Kathode. Der umgekehrte Vorgang findet beim Laden statt. Die frisch aufgeladenen Lithium-Ionen transportieren danach wieder Elektronen durch Elektrolyt und Trennschicht zur Anode. In Wirklichkeit ist alles etwas komplizierter, aber Sie wollen hier bestimmt nichts über Kohlenstoff-Interkalationsverbindungen lesen.
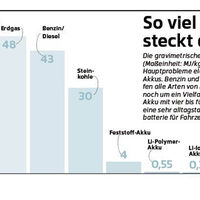
Der erste Lithium-Ionen-Akku wurde bereits zu Beginn der 70er-Jahre in München erforscht und entwickelt, doch zu einer praktischen Anwendung kam es nicht. Erst die Verbreitung von energiedurstiger Unterhaltungselektronik und Mobiltelefonie ab Mitte der 80er brachte den Lithium-Ionen-Akku ins Gespräch. Und ins Elektroauto. Ein bleibendes Problem jeglicher Batterietechnik ist die Energiedichte, daran hat die Lithium-Ionen-Technik ein wenig, aber nicht viel geändert. Die Energiedichte beschreibt das Verhältnis von Masse und Energiegehalt eines Energieträgers und wird in Megajoule pro Kilogramm (MJ/kg) gemessen.
Die Batterieentwicklung hat in den letzten Jahren augenscheinlich nur geringe Fortschritte gemacht hat. Man kann es auch anders darstellen: Während man mit einem Kilogramm Diesel (vereinfacht ein Liter Kraftstoff plus das anteilige Gewicht von Tank und Kraftstoffsystem) mit einem sparsamen modernen Auto durchaus 20 Kilometer weit fahren kann, kommt man mit einem Kilogramm Lithium-Polymer-Akku vielleicht einen Kilometer weit.
Experten schätzen, dass sich diese Reichweite mit Lithium-Ionen- oder Lithium-Polymer-Akkus noch etwas steigern lässt, doch große Sprünge sind dabei kaum zu erwarten. Hinzu kommt, dass die Reichweite temperaturabhängig ist – je kälter das System wird, desto weniger Energie kann es abgeben. Ein Effekt, der auf Lithium-Polymer-Akkus ebenso zutrifft wie auf die altersmüde Blei-Säure-Starterbatterie im betagten Diesel-Mini-Van des Nachbarn.
Lithium-Polymer- sind Lithium-Ionen-Akkus, bei denen die Elektrolyt-Flüssigkeit durch Gel aus Polymer-Kunststoff ersetzt wird. Der Vorteil: Die Akkus lassen sich in fast beliebiger Form bauen. Und sie haben eine höhere Energiedichte als Li-Io-Zellen. Doch sie benötigen ein aufwendiges Lade- und Temperaturmanagement, weil sie sich leicht selbst entzünden. Ein Problem, mit dem Samsung und Tesla bereits unfreiwillig Erfahrungen sammelten.
Noch keine perfekte Zelle
Ein weiterer Nachteil batterieelektrischen Betriebs fällt dagegen bei Fahrzeugen buchstäblich weniger ins Gewicht, wohl aber bei Fluggeräten: Während der flüssige Treibstoff verbrennt und sich in gasförmigem Zustand verabschiedet, das Fahr- oder Flugzeug also leichter wird, bleibt die Batterie immer gleich schwer. Das ist auch bei Feststoff-Akkus nicht anders. Die Forscher versprechen sich andere Vorteile von dieser Technik, obwohl die Zellchemie die gleiche ist. Doch Elektroden und die Elektrolytschicht sind mikrometerdünn auf Folie geprägt, die Herstellung ist noch entsprechend aufwendig und teuer.
Die kostspieligen und problematischen Rohstoffe Lithium und Kobalt werden ebenfalls benötigt, obwohl inzwischen an anderen Metallen zur Ionen-Gewinnung geforscht wird. Zudem sind noch einige Probleme ungelöst, etwa die der Haftung der verschiedenen Schichten und der geringen aktiven Oberfläche zwischen Elektroden und Elektrolyt. Trotzdem setzen Autohersteller große Hoffnungen in die Feststofftechnologie. Seri- eneinsatz? Unklar.
Das gilt noch mehr für die Flusszellen- oder Redox-Akkus. Die sind als große Energiespeicher bereits im Einsatz, etwa als Pufferbatterien für Windkraftanlagen. Dabei fördern Pumpen die Elektrolyt-Flüssigkeit an Anode und Kathode vorbei. Die Elektroden sind durch eine für Ionen durchlässige Membrane getrennt.

Eine neuartige mobile Anwendung nimmt die Firma NanoFlowcell für sich in Anspruch. Dabei wird die Elektrolyt-Flüssigkeit verdampft, die gelösten Salze nimmt ein Filter auf. Ist der Vorrat verbraucht, wird die Flüssigkeit nachgetankt. Zwar führte NanoFlowcell bereits Prototypen vor, aber ein Nachweis nachhaltiger Funktion fehlt bislang. Die perfekte Zelle wurde anscheinend auch hier noch nicht entdeckt. Die Suche geht also weiter, 208 Jahre nach Johann Wilhelm Ritter.



 9Bilder
9Bilder














